研究紹介
ペプチド核酸(PNA)による遺伝子制御
生体内で機能を司るタンパク質は全てDNA情報によって暗号化されている。細胞内ではDNAの必要部分のみがコピー(転写)されてmRNAとなり、それを基にタンパク質が合成(翻訳)されている。多くの病気がタンパク質の過剰発現、または発現量不足など、タンパク質に起因しているため、タンパク質を治療標的とした薬剤開発が進んできたが、近年、ヒトゲノムの解読を契機にDNAやRNAをターゲットとする核酸医薬の研究が進展してきた。
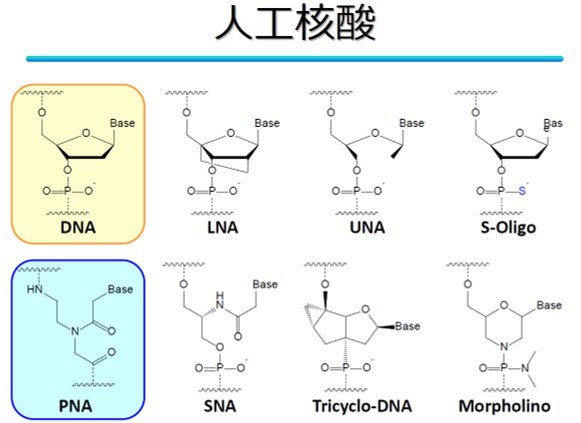
DNAやRNAはアデニン(A)、チミン(T)(RNAの場合はウラシル(U))、シトシン(C)、グアニン(G)の4つの核酸塩基を持つ生体高分子で、水素結合により、A-T、G-Cペアになることが出来るため、ペアになる核酸塩基を持つ相補鎖と二本鎖を形成する特徴を有している。核酸医薬ではDNA、RNAが有する塩基配列情報を基に、特定の箇所に相補的な塩基配列を持つ人工核酸を加え、二本鎖形成をさせることで、病気に関連しているタンパク質の発現を制御し、治療を目指すものである。核酸医薬に用いるために、人工核酸には生体内での安定性の他、標的塩基配列との強い結合、標的配列以外の部分へ結合しない能力(ミスマッチ認識能)など、多くの性質が求められる。より良い人工核酸を求め、世界中で多くの研究者が様々な人工核酸を開発している。
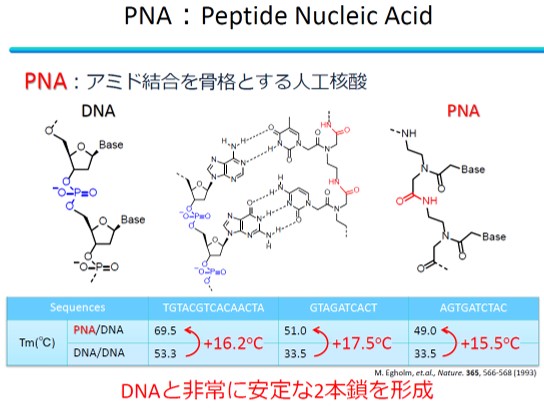
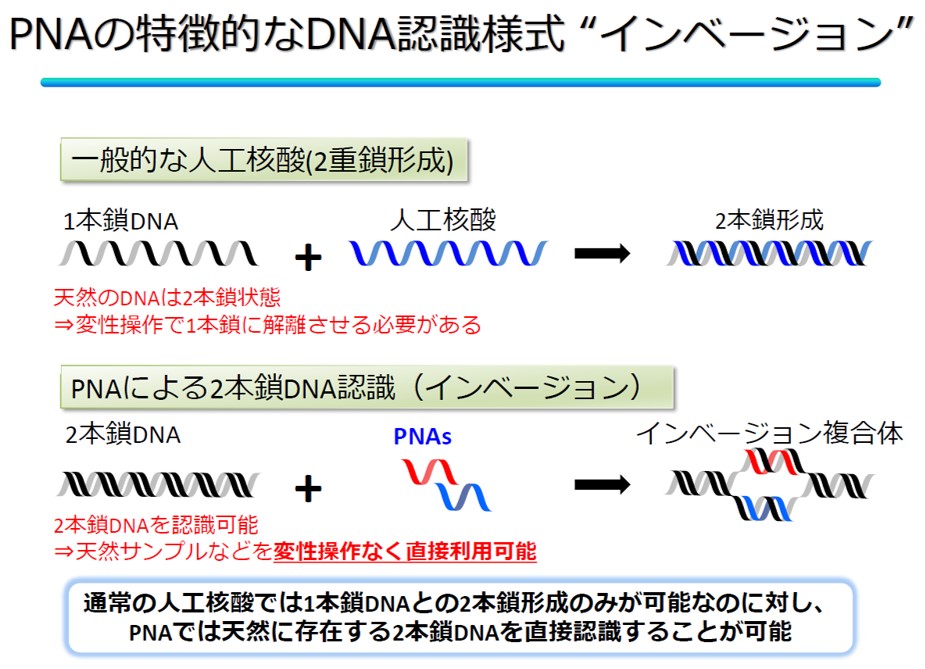
当研究室ではその中でもペプチド核酸(Peptide Nucleic Acid, PNA)に注目して研究を進めている。PNAはアミド結合を骨格とする人工核酸で、リン酸ジエステル骨格を有するDNAが負電荷を帯びているのに対し、PNAは電荷を帯びていない。通常、DNA-DNA二本鎖形成では、二本鎖間の負電荷同士の反発が生じるが、PNAの場合は電荷を持たないため、静電反発を受けることなく、標的のDNAと非常に安定な二本鎖を形成する事が出来る。さらに、PNAには他の人工核酸にはない特徴的なDNA結合様式「インベージョン」を行う能力を有している。通常、生体内ではDNAは安定な二重らせん構造を形成しており、一般的な人工核酸では標的のDNAと二本鎖形成する際に、一度、天然のDNAを変性操作で一本鎖にする必要がある。DNAの二重らせんをほどくには高温条件などを必要とし、生体への応用の障害となる。一方、PNAはDNAの二重らせん構造そのものに侵入(invasion)するように結合し、インベージョン複合体を形成することが出来るため、核酸医薬など生体内での応用が期待出来る。
最新のPNA研究に関してはreviewで解説しています。
- Y. Aiba, M. Shibata, O. Shoji "Sequence-Specific Recognition of Double-Stranded DNA by Peptide Nucleic Acid Forming Double-Duplex Invasion Complex" , Appl. Sci., 12, (2022) 3677.
https://doi.org/10.3390/app12073677
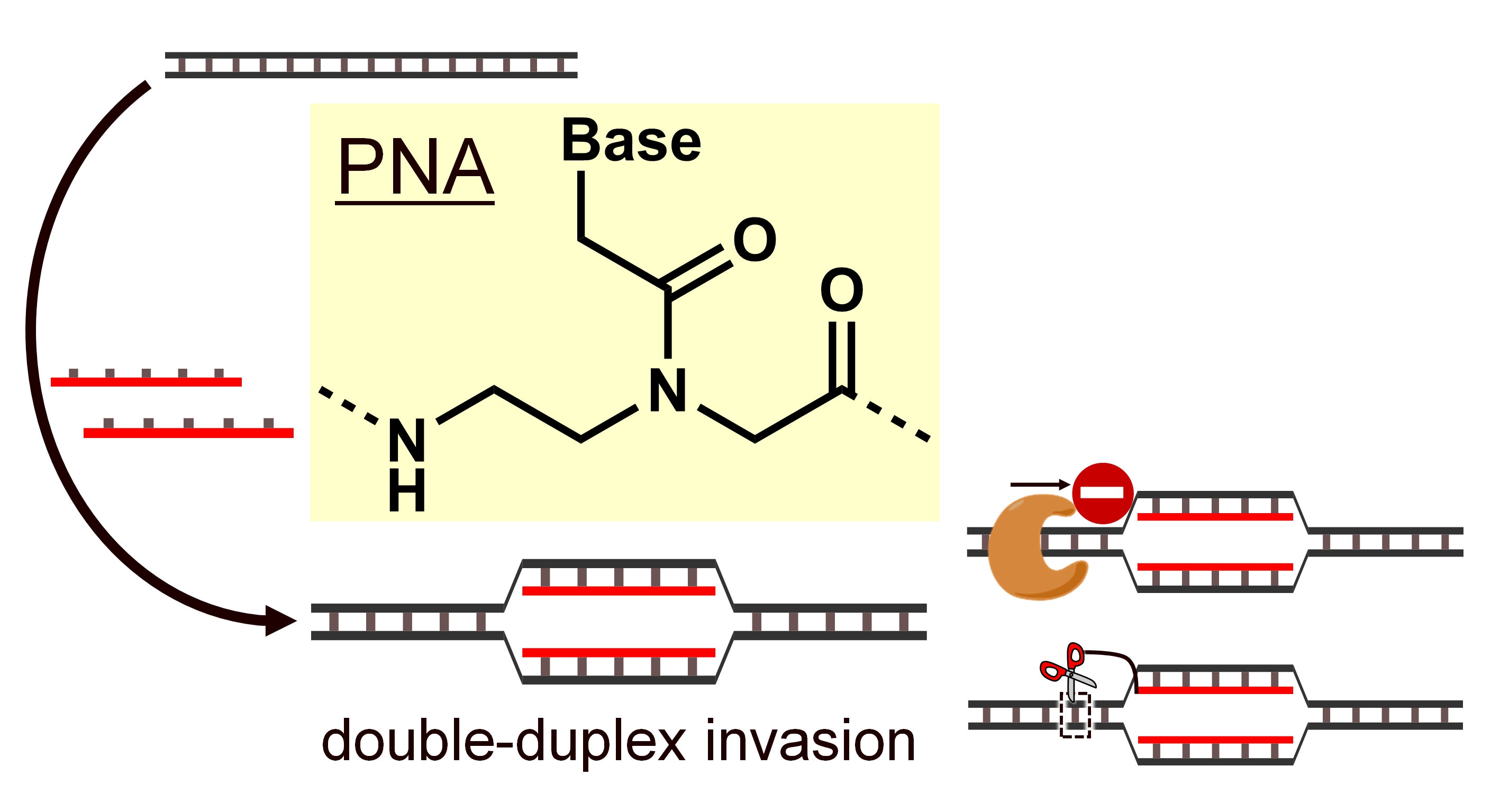
第1話: ルテニウム錯体連結によるPNAのinvasion効率向上
第2話: グアニンのメチル化によるカチオン性グアニン導入PNA(masaPNA)


